Articles
- Page Path
- HOME > Res Community Public Health Nurs > Volume 34(2); 2023 > Article
-
Original Article
한국 성인 남녀의 신체 표현형에 따른 대사증후군 발생 위험 평가 : 지역사회기반 코호트 자료 분석 -
김지영1
 , 양영란2
, 양영란2
- Assessment of Metabolic Syndrome Risk Based on Body Size Phenotype in Korean Adults: Analysis of Community-based Cohort Data
-
Ji Young Kim1
 , Youngran Yang2
, Youngran Yang2
-
Research in Community and Public Health Nursing 2023;34(2):158-170.
DOI: https://doi.org/10.12799/rcphn.2023.00101
Published online: June 30, 2023
1원광보건대학교 간호학과 조교수
2전북대학교 간호대학∙간호과학연구소 교수
1Assistant Professor, Department of Nursing, Wonkwang Health Science University, Iksan, Korea
2Professor, College of Nursing, Research Institute of Nursing Science, Jeonbuk National University, Jeonju, Korea
- Corresponding author: Yang, Youngran College of Nursing, Research Institute of Nursing Science, Jeonbuk National University, 67 Baekje-daero, Deokjin-gu, Jeonju-si, Jeollabuk-do, South Korea (54896) Tel: +82-63-270-3116,Fax:+82-63-270-3127, E-mail: youngran13@jbnu.ac.kr
Copyright © 2023 Korean Academy of Community Health Nursing
This is an Open Access article distributed under the terms of the Creative Commons Attribution NoDerivs License. (http://creativecommons.org/licenses/by-nd/4.0) which allows readers to disseminate and reuse the article, as well as share and reuse the scientific material. It does not permit the creation of derivative works without specific permission.
- 1,193 Views
- 44 Download
Abstract
-
Purpose
- Body size phenotypes can be regarded as an indicator of cardiovascular incidence risk factors. The aim of this study was to investigate the incidence of metabolic syndrome among metabolically healthy adults according to body size phenotype using Korean Genome & Epidemiology Study [KoGES]-community based cohort from 2001-2002 to 2014.
-
Methods
- A prospective population-based cohort including 5,068 adults aged 40-69 years free from metabolic syndrome was included and divided into three phenotypes: metabolically healthy normal weight (MHNW), metabolically healthy overweight (MHOW), and metabolically healthy obesity (MHO). The time dependent Cox’s proportional hazards regression model was used to estimate the incidence of the metabolic syndrome after a follow-up 14 years.
-
Results
- In the demographic, health related variables-adjusted model (Model 3), the hazard ratio of the metabolic syndrome was 1.92 (CI 1.54-2.40) for MHOW, 2.88 (CI 2.32-3.58) for MHO among males, 1.89 (CI 1.51-2.37) for MHOW, 2.34 (CI 1.88-2.90) for MHO for females compared to MHNW, respectively.
-
Conclusion
- In conclusion, MHOW and MHO in both males and females increased the risk of metabolic syndrome compared to MHNW. Obesity management should be considered even in the absence of metabolic syndrome. Programs and resources should be provided for prevention of cardiovascular diseases and better quality of life.
- 1. 연구의 필요성
- 세계 대사증후군 유병률은 정의에 따라 약 12.5%에서 31.4%로 지리적 위치와 경제적 수준에 따라 다양하게 보고되고 있으며[1], 우리나라 성인의 대사증후군 유병률은 2013년 22.6%에서 2018년 30.4%로 빠르게 증가하고 있다[2]. 대사증후군은 인슐린 저항성 및 복부지방의 증가된 수준, 낮은 수준의 고밀도지단백 콜레스테롤, 높은 수준의 중성지방, 공복혈당장애 및 고혈압 등 신체 대사를 나타내는 핵심적인 위험인자의 군집 상태로 87개 연구에 참여한 951,083명을 대상으로 한 메타분석결과에 따르면 심뇌혈관질환 발생률을 2.35배, 심뇌혈관질환으로 인한 사망률을 2.4배 증가시킨다[3]. 대사증후군 5개 구성요소(고혈압, 고혈당, 복부비만, 고중성지방혈증, 낮은 고밀도콜레스테롤) 중 1개만 가지고 있어도 심혈관계질환과 당뇨병 발생률이 증가한다고 보고되고 있는데[4], 1개 이상 요소에서 기준치를 초과한 우리나라 인구는 2013년 71.6%(남자 77.7%, 여자 64.3%)에서 2018년 78.5%(남자 82.5%, 여자 73.6%)로 매우 심각한 수준에 있다[2].
- 비만은 심혈관계질환 및 암과 같은 만성 비전염성 질환의 고위험요인으로 주요 공중 보건 문제로 장기적으로 부정적인 건강결과를 야기한다는 사실은 매우 잘 알려져 있다[5]. 그러나 동일한 정도의 비만 상태라 할지라도 개인은 혈중지질 농도, 인슐린 감수성, 혈압 및 복부비만과 같은 대사 기능에 상당한 수준의 이질성이 존재하고 있어 개인의 건강상태를 제대로 설명하지 못하는 한계가 있어 비만과 대사 건강(metabolic health)에 따라 분류하는 신체 표현형(body size phenotype) [15]에 관심이 모아지고 있다. 비만 인구의 일부 집단에서 내장 지방량과 이소성 지방 침착이 적고 유리한 대사 프로필을 가지고 있어 제2형 당뇨병과 심혈관계질환으로부터 보호되는 대사적으로 양성인 집단을 ‘대사적으로 건강한 비만(Metabolically Healthy Obesity, MHO)’ 혹은 ‘양성비만(benign obesity)’으로 지칭하고 있다[6,7].
- 대사적으로 건강한 비만군은 높은 체질량지수를 보이지만 정상적인 인슐린 감수성, 안정된 혈압, 혈당, 지질, 염증 지표 등과 같은 대사 이상이 없어 체중 감소가 필요하지 않은 것으로 간주될 수 있지만[8,9] 시간이 지남에 따라 고혈압, 당뇨병 등의 비만과 관련된 심각한 문제를 겪게 되며 대사증후군 발생 위험도 높아 건강한 체중과 생활습관을 유지하고 대사 건강상태를 신중하게 감시하여야 한다[15]. 대사적으로 건강한 비만군을 평균 17.7년[10], 30년[11] 동안 추적 관찰한 결과, 정상체중군보다 대사적으로 건강한 비만군의 사망률 및 심혈관계질환 발생이 유의하게 증가되었다. 그런데 10년 이상 경과된 시점에서 정상체중군과 차이를 보이기 시작했으며 추적 기간이 길수록 대사적으로 건강한 비만군에 대한 위험도가 유의하게 증가하는 것을 알 수 있어 대사적으로 건강한 비만군은 대사적 위험군으로 이행하는 중간단계일 것으로 추정된다. 대사증후군 환자의 체중을 5∼10% 감소시키면 예후가 상당히 개선되는 것으로 보고되고 있어[12] 대사적으로 건강한 비만군의 대사증후군 위험인자 및 이환율을 평가하여 예방하는 데 기여할 것이다.
- 미국 성인에서 대사적으로 건강한 비만군은 6년 후에는 대사적으로 건강한 정상체중군보다 대사증후군 발생 위험이 1.16배 높으며[13], 중국 성인에서는 7년 후 대사적으로 건강한 과체중군 1.05배, 대사적으로 건강한 비만군 1.23배 높다고 보고된 바 있다[14]. 국내 연구에서도 대사적으로 건강한 남자 비만군은 정상체중군에 비해 8년 후 대사증후군 발생 위험이 1.84배 높았고[15], 대사적으로 건강한 정상체중군은 11.1%, 대사적으로 건강한 비만군은 31.5%가 대사적으로 건강하지 않은 상태로 전환되었다[16]. 그러나, 이러한 연구들은 연구대상자가 소수이거나 8년 미만으로 추적 기간이 충분하지 않고 추적 기간 동안 비만상태의 변화를 반영하지 못해 정확한 신체 표현형에 따른 대사증후군의 발생 위험 평가로는 한계가 있다.
- 대사증후군의 발생 위험은 유전적 요인, 생활환경 여건 등에 따라 악화 인자가 다양하므로 대사증후군을 잘 관리하기 위해서는 고위험집단의 악화 인자를 파악하여 예방적 중재와 적절한 치료적 접근을 시도하는 것이 필요하므로 전향적 코호트 연구가 필요하다[17]. 따라서, 본 연구는 국내 최장 기간인 14년간 추적 조사한 대규모 전향적 코호트 자료를 이용하여 한국 성인 남녀의 신체 표현형에 따른 대사증후군 발생 위험을 평가하여 대사증후군 예방에 필요한 기초 자료를 제공하고자 시도되었다. 특히 신체 표현형의 시간에 따른 변화를 반영하였다는 점에서 기존 연구와 큰 차별성이 있다.
- 2. 연구 목적
- 본 연구는 한국 성인 남녀의 신체 표현형이 대사증후군 발생에 미치는 영향을 확인하기 위하여 1) 인구사회학적 및 건강관련 특성에 따른 대사증후군 발생률을 파악하고, 2) 신체 표현형에 따른 대사증후군 누적 발생률을 파악하며, 3) 신체 표현형에 따른 대사증후군의 발생 비례위험을 평가하는 것이다.
서론
- 1. 연구 설계
- 본 연구는 2001년부터 2002년까지의 기반조사를 시작으로 2016년까지 14년에 걸쳐 특정한 연구대상(코호트)을 2년 주기로 추적 조사된 지역사회기반 코호트 표본을 이용하여 성인 인구집단을 모집단으로 하여 신체 표현형에 따른 대사증후군 발생 위험을 평가하기 위한 전향적 코호트 표본 한국인유전체역학조사사업(Korean Genome & Epidemiology Study, KoGES) 자료를 활용한 이차분석 연구이다.
- 2. 연구대상 및 자료수집
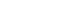
- 본 연구는 2001년부터 2016년(7차)까지 중소도시 안산 및 농촌지역 안성에 거주하는 40~69세 남녀 주민을 중심으로 조사된 지역사회기반 코호트에 참여한 10,030명 중 기반조사에서 다음 기준을 충족하는 대상은 제외하였다. (1) 체질량지수(Body Mass Index, BMI)가 18.5kg/m2 미만인 자(n=179); (2) 65세 이상인 자(n=1,256); (3) 만성질환(심근경색, 울혈성심부전, 관상동맥질환(협심증 등), 갑상선질환, 신장질환, 말초혈관질환, 뇌혈관질환) 또는 각종 암을 의사에게 진단 받은 자(n=366); (4) 조사하고자 하는 항목에 결측치가 있는 자(n=398); (5) National Cholesterol Education Program Adult Treatment Panel III (NCEP ATP Ⅲ)[21] 기준 중 3가지 이상에 해당하여 대사증후군으로 판명된 자(n=2,763)를 제외한 후 최종 5,068명의 자료를 분석에 활용하였다. 본 연구의 대상자 선정과정은 Figure 1과 같다.
- 한국인유전체역학조사사업은 질병관리청 국립보건연구원 유전체역학과에서 추진하는 6개 코호트 사업으로 구성되어 있으며 본 연구에서는 지역사회기반 코호트를 사용하였다. KoGES는 한국인에서 호발 주요 만성질환의 유전-환경적인 요인을 밝히고 이들 간의 상호작용을 파악 및 질병 예방을 위한 관리지침 수립을 목표로 기반조사 이후부터 2년 주기로 조사하는 국가 주도 코호트 사업이다. 지역사회기반 코호트는 10,030명을 대상으로 기반조사를 시작하여 1차 추적 8,603명, 2차 추적 7, 515명, 3차 추적 6,688명, 4차 추적 6,665명, 5차 추적 6,238명, 6차 추적 5,906명, 7차 추적 6,318명이 추적 조사되었다. KoGES 역학자료 분양 신청은 ‘질병보건통합관리시스템(is.cdc.go.kr)’을 통하여 연구자가 역학자료 분양 신청서, 연구계획서 및 연구윤리심의위원회 승인서(또는 면제서), 요청 변수 목록 및 역학자료 활용에 대한 동의서를 작성하여 제출한 후 담당부서 심의 후 자료분양을 받았다.
- 3. 연구의 변수
- 신체 표현형은 체중과 신장을 이용해 체중(kg)/신장2(m2)의 공식으로 체질량지수를 산출하고, 대한비만학회[18] 기준에 따라 3가지로 분류하였다[15]. 연구대상자는 모두 대사적으로 건강한 상태이므로 ① 대사적으로 건강한 정상체중(Metabolically Healthy Normal Weight, MHNW)은 BMI가 18.5㎏/m2 이상 23㎏/m2인 경우, ② 대사적으로 건강한 과체중(Metabolically Healthy Over Weight, MHOW)은 BMI가 23㎏/m2 이상 25㎏/m2 미만인 경우, ③ 대사적으로 건강한 비만(Metabolically Healthy Obesity, MHO)은 BMI가 25㎏/m2 이상인 경우로 하였다.
- 허리둘레는 가장 아래에 위치한 늑골과 골반 장골능 상부의 중간 부위인 둘레를 줄자를 이용하여 수평으로 유지한 상태에서 0.1cm 단위까지 3회 측정된 평균값을 이용하였으며, 혈압은 미국심장협회(American Heart Association, AHA) 프로토콜에 따라 앉은 자세에서 편안한 상태로 팔을 심장 높이로 두고 수동혈압계와 청진법으로 양쪽 팔에서 두 번 측정된 수축기혈압 및 이완기혈압의 평균값을 이용하였다.
- 혈액 지표는 8시간 공복상태에서 정맥혈을 채취하여 자동분석기(ADVIA, 1800)를 이용하여 총 콜레스테롤, C-반응성 단백, 공복 인슐린, 공복 혈당, 중성지방, 고밀도지단백 콜레스테롤(High Density Lipoprotein Cholesterol, HDL-C), HbA1c(Hemoglobin A1c), 경구당부하검사(Oral Glucose Tolerance Test, OGTT)로 120분 후 증가된 포도당 농도, 비 고밀도지단백 콜레스테롤(Non High Density Lipoprotein Cholesterol, Non HDL-cholesterol)을 측정하였으며 비 고밀도지단백 콜레스테롤은 총 콜레스테롤과 고밀도지단백 콜레스테롤의 차이로 산출하였다. 인슐린 저항성에 대한 항상성 모델인 Homeostasis Model Assessment of Insulin Resistance(HOMA-IR)는 Excel의 HOMA2 계산기를 사용하여 계산하였다[19].
- 연령은 기반조사 시점을 기준으로 40∼49세, 50∼59세, 60∼64세로 구분하였으며, 배우자 유무는 ‘있음(기혼, 별거, 동거)’, ‘없음(미혼, 사별, 이혼, 기타)’으로, 직업 유무는 ‘있음’, ‘없음’으로 구분하였다. 교육수준은 ‘고졸 이하’, ‘대졸 이상’ 범주로 구분하였으며, 소득수준은 가구의 월 평균 소득수준을 조사하여 ‘200만원 미만’, ‘200∼400만원 미만’, ‘400만원 이상’ 범주로 구분하였다.
- 주관적 건강상태는 ‘전반적으로 당신의 건강상태는 어떻다고 생각하십니까?’의 문항에 따라 ‘건강함(건강하다, 매우 건강하다)’, ‘보통(보통이다)’, ‘나쁨(건강하지 못하다, 매우 건강하지 못하다)’으로 구분하였으며, 피로 유무는 ‘최근 피로를 자주 느끼십니까?’의 문항에 따라 ‘예’, ‘아니오’의 응답에 따라 이분 변수로 구분하였다. 흡연은 ‘지금까지 담배를 통틀어 20갑(400개피) 이상 피웠습니까?’의 문항에 따라 ‘비흡연’, ‘과거 흡연’, ‘현재 흡연’으로 구분하였으며, 음주는 ‘원래 술을 못 마시거나 또는 처음부터(종교적인 이유 등으로) 술을 안 마십니까?’의 문항에 따라 ‘비음주’, ‘과거 음주’, ‘현재 음주’로 재분류하였다.
- 신체활동 여부는 설문조사에서 1회 운동시 30분 이상이면서 주 4∼5회 이상 운동 여부를 근거로 하여 ‘한다’, ‘안 한다’로 구분하였다. 하루 평균 수면시간은 부족한 수면시간인 경우 ‘6시간 이하’, 적절한 수면시간인 경우 ‘7∼8시간’, 과다한 수면시간인 경우 ‘9시간 이상’으로 구분하고, 하루 에너지 평균 섭취량은 식품섭취 빈도조사법(Food Frequency Questionnaire, FFQ)을 이용하여 조사하고 이를 2010년 한국 영양학회에서 제정한 ‘한국인 영양섭취기준’에 따라 산출된 값을 사용하였다[20]. 고혈압 및 당뇨병 가족력은 과거 해당 질환을 진단받은 적이 있는지를 묻는 문항을 이용하여 ‘있음’, ‘없음’으로 구분하였으며 폐경은 여성력 조사에서 ‘최근 3개월간 생리가 있었습니까?’의 문항에 ‘아니오, 지난 12개월 이상 생리가 없었다’에 해당하여 조사된 폐경 나이를 조사하였다. 폐경 여부를 알 수 있는 조사 항목은 2차 추적 조사부터 추가된 문항으로 기반조사 시점에서의 폐경 연령을 역 추적하여 폐경 여부를 결정하였다.
- 대사증후군은 NCEP ATP Ⅲ [21] 기준 중 3가지 이상에 해당하는 경우로 하였다. ① 허리둘레(남자>90 cm, 여자>80 cm), ② 중성지방 150 mg/dL 이상이거나 이상지질혈증약을 복용 중인 경우, ③ 고밀도지단백 콜레스테롤(남자<40 mg/dL, 여자<50 mg/dL), ④ 공복혈당 100 mg/dL 이상이거나 당뇨병약을 복용 중이거나 인슐린 주사를 맞는 경우, ⑤ 수축기혈압≥130 mmHg 또는 이완기혈압≥85 mmHg 이상이거나 혈압조절제 복용 중인 경우 이들 5가지 위험요인 중 3가지 이상을 만족할 때 대사증후군으로 판정하였다.
- 대사증후군의 발생률은 기반조사에서 판정 기준에 해당되지 않았으나, 추적 조사에서 새롭게 진단된 사람의 분율로 계산하였다.
- 4. 자료 분석 방법
- 대상자의 특성에 따른 신체 표현형 비교 및 대사증후군 발생 유무 분석을 위해 Chi-square test, Fisher exact test, Independent t-test, one-way ANOVA, 사후검정으로 Scheffé test를 실시하였다. 신체 표현형을 기준으로 1,000인년(Person-Year) 당 위험 사례 수로 14년 대사증후군 누적 발생률을 계산하였다. 대상자의 신체 표현형이 시간경과의 변화에 따른 대사증후군 누적 발생률의 집단 간 생존함수의 비교를 위해 로그순위분석법(Log-rank method)을 이용하였고 생명표(Life table) 분석으로 도식화하였다. 대상자의 신체 표현형에 따른 대사증후군 발생의 위험을 비교하기 위해 시간의존 콕스의 비례위험 회귀모형(Time-dependent Cox’s proportional hazards regression model)을 이용하여 단일 변수분석을 실시하였다. 비례위험 회귀모형의 가정의 검정을 위한 자료의 모델 적합도 평가는 Log Minus Log survival plot (LML plot)을 통해 신체 표현형의 대사증후군 발생에 대한 그래프가 서로 평행으로 일정한 거리를 유지하고 있는지 확인하였다. 대사적으로 건강한 정상체중군을 참조그룹(reference group)으로 설정하고 위험 비율(Hazard Ratio, HR) 과 95% 신뢰구간(Confidence Interval, CI)을 사용하여 대사증후군 발생률에 대한 상대적 위험(relative risk)을 추정하였다. 남자와 여성을 나누어 각각 3개의 Model로 분석하되 Model 1은 통제 변수 없는 단변량으로, Model 2는 인구사회학적 특성(연령, 직업 유무, 소득수준)을 통제 변수로 투입하였으며, Model 3은 Model 2의 통제 변수와 건강관련 특성을 포함시키되 단변량 분석결과를 기반으로 남자의 경우는 고혈압 가족력을, 여자의 경우에는 주관적 건강상태, 하루 평균 수면시간, 폐경 유무를 통제 변수로 포함시켜 분석하였다. 이를 위해 추적 조사 기간 중 대사증후군이 발생한 대상자는 해당 사건(event)의 발생으로, 추적 조사 기간이 종료되는 시점까지 대사증후군이 발생하지 않은 대상자는 중도절단(censored)된 경우로 간주하였다. 자료분석은 IBM SPSS Statistics 26.0을 이용하였고, 모든 통계적 유의수준은 p<.05로 설정하였다.
- 5. 윤리적 고려
- KoGES에서 수집된 개인 정보는 통계법 제33조 및 34조에 근거하여 철저하게 보호되고 있다(http://www.law.go.kr/법령/통계법/(20180210,14843,20170809)/제34조). KoGES는 조사 시작 전에 모든 참여 대상자에게 연구 참여에 대한 설명서를 활용하여 소요 시간, 이점과 불편감, 정보화된 동의를 구하고 자료 구축과 관련된 윤리적 문제를 최소화하였다. 본 연구의 윤리적 고려를 위하여 연구자 소속의 생명윤리심의위원회의 승인(No. JBNU 2020-04-019)을 얻은 후 질병관리청 국립보건연구원의 심의를 거쳐 최종 승인(No 4851-302)을 받아 진행되었으며 연구 종료 후 질병관리청에 자료 폐기확인서를 제출함으로써 연구윤리 규정을 준수하였다.
연구방법
1) 연구대상
2) 자료수집
1) 독립변수
(1) 신체 표현형
(2) 신체계측
(3) 혈액분석
(4) 인구사회학적 특성
(5) 건강관련 특성
2) 종속변수
(1) 대사증후군
- 1. 대상자의 특성에 따른 대사증후군 발생
- 대상자의 특성에 따른 14년 추적 조사 동안 대사증후군의 발생 유무는 Table 1과 같다. 먼저 남자 총 2,684명 중 대사증후군 발생군 1,113명(41.5%), 비발생군 1,571명(58.5%)이었으며, 발생군과 비발생군의 특성에 따라 차이를 보인 변수는 연령(χ2=7.40, p=.025), 직업 유무(χ2=10.20, p=.003), 소득수준(χ2=6.93, p=.031), 고혈압 가족력(χ2=18.04, p<.001)이었다. 대사증후군 발생률은 60∼64세(48.5%)가 40∼49세(40.3%)에 비해 더 높았으며, 직업이 있는 경우(43.1%), 소득수준이 400만원 이상인 경우(46.4%), 고혈압 가족력이 없는 경우(60.4%) 대사증후군 발생률이 높았다.
- 여자 총 2,384명 중 대사증후군 발생군 1,032명(43.3%), 비발생군 1,352명(56.7%)이었으며, 발생군과 비발생군의 특성에 따라 차이를 보인 변수는 연령(χ2=92.66, p<.001), 직업 유무(χ2=13.24, p<.001), 교육수준(χ2=13.21, p<.001), 소득수준(χ2=54.56, p<.001), 주관적 건강상태(χ2=6.15, p=.046), 하루 평균 수면시간(χ2=14.05, p=.001), 폐경 유무(χ2=68.76, p<.001)이었다. 대사증후군 발생률은 60∼64세(60.7%)가 40∼49세(36.0%)에 비해 더 높았으며, 직업이 있는 경우(48.2%), 교육수준이 고졸이하인 경우(44.4%), 소득수준이 200만원 미만인 경우(49.1%), 주관적 건강상태는 평소 자신의 건강상태를 보통이라고 평가하는 경우(45.4%), 하루 평균 수면시간이 9시간 이상인 경우(51.9%), 폐경을 한 경우(63.5%) 대사증후군 발생률이 높았다.
- 2. 신체 표현형에 따른 대사증후군의 누적 발생률
- 대상자의 신체 표현형에 따른 대사증후군 누적 발생률은 Table 2와 같다. 대사증후군 발생 건수와 관찰 기간의 합은 남자의 경우 총 21,724.50인년이고, 대사증후군 발생률은 1,000인년 당 MHNW군 29.3건, MHOW군 54.3건, MHO군 81.9건으로 신체 표현형에 따른 대사증후군 발생률에 유의한 차이가 있었다(F=92.83, p<.001). 전체 관찰기간의 중앙값은 94.9개월, 평균값은 97개월이었다. MHNW군의 대상자는 998명, 대사증후군 발생자는 268명(26.9%), 총 관찰인년은 9,138.70, MHOW군의 대상자는 848명, 대사증후군 발생자는 366명(43.2%), 총 관찰인년은 6,740.40, MHO군의 대상자는 838명, 대사증후군 발생자는 479명(57.2%), 총 관찰인년은 5,845.40이었다. 사후분석 결과, MHO군이 MHOW군과 MHNW군에 비해 대사증후군 발생률이 높았다(F=92.83, p<.001).
- 여자의 경우 총 18,912.50인년이고, 대사증후군 발생률은 1,000인년 당 MHNW군 31.5건, MHOW군 57.7건, MHO군 85.8건으로 신체 표현형에 따른 대사증후군 발생률에 유의한 차이가 있었다(F=81.48, p<.001). 전체 관찰기간의 중앙값은 95.4개월, 평균값은 95.1개월이었다. MHNW군의 대상자는 899명, 대사증후군 발생자는 253명(28.1%), 총 관찰인년은 8,031.90, MHOW군의 대상자는 679명, 대사증후군 발생자는 316명(46.5%), 총 관찰인년은 5,481.80, MHO군의 대상자는 806명, 대사증후군 발생자는 463명(57.4%), 총 관찰인년은 5,398.80이었다. 사후분석 결과, MHO군이 MHOW군과 MHNW군에 비해 대사증후군 발생률이 높았다(F=81.48, p<.001).
- MHNW군, MHOW군, MHO군의 로그 순위 검정(Log-rank test)을 수행한 결과, 신체 표현형 별 대사증후군 누적 발생률에 차이가 있었으며(p<.001), MHO군에서 대사증후군 발생의 증가는 기간에 따라 점진적으로 증가하는 곡선을 보였다(Figure 2).
- 3. 신체 표현형에 따른 대사증후군 발생 비례위험
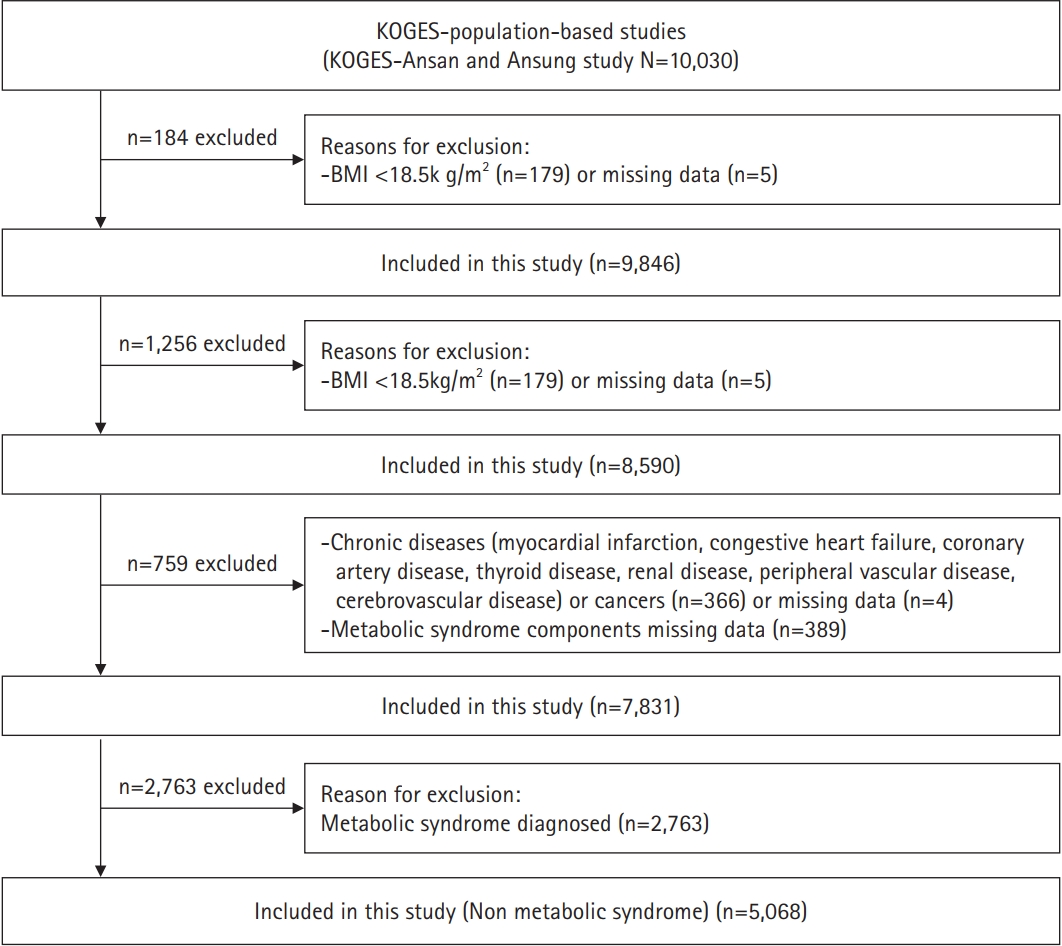
- 본 연구의 모델 적합도 평가는 Log Minus Log survival plot (LML Plot)으로 확인하였다. LML Plot에서 신체 표현형의 대사증후군에 대한 그래프가 서로 평행하므로 해당 모형은 비례위험 가정을 만족하였다(Figure 3).
- 대상자의 신체 표현형에 따른 대사증후군의 발생 비례위험을 확인하기 위해 시간의존 콕스의 비례위험 회귀모형(Time dependent Cox’s proportional hazards regression model) 분석 결과는 Table 3과 같다. 본 연구에서는 신체 표현형을 시간의존 독립변수로 선정하였기 때문에 시간의존 독립변수로 새로이 만들 필요가 있다. 즉, 신체 표현형은 T_COV로 시간의존 독립변수로 전환하였으며 2년 간격으로 7차 추적 조사된 자료를 각각 하나의 시간의존자료로 묶어 사용하였다. 가령 2차년도의 신체 표현형은 해당 종속변수에 그리고 4차년도의 신체 표현형은 4차년도의 종속변수에 영향을 미치도록 하였다.
- 분석결과 남자의 경우에는 신체 표현형에 따른 대사증후군 발생의 위험은 MHNW군에 비해 Model 1에서 MHOW군 1.90배(95% CI=1.53∼2.36), MHO군 2.80배(95% CI=2.26∼3.46), Model 2에서 MHOW군 1.91배(95% CI=1.53∼2.38), MHO군 2.92배(95% CI=2.35∼3.62), Model 3에서 MHOW군 1.92배(95% CI=1.54∼2.40), MHO군 2.88배(95% CI=2.32∼3.58)로 시간에 따라 대사증후군 발생 위험이 증가하였으며 모두 통계적으로 유의하였다.
- 여자의 경우에는 신체 표현형에 따른 대사증후군 발생의 위험은 MHNW군에 비해 Model 1에서 MHOW군 1.88배(95% CI=1.52∼2.34), MHO군 2.46배(95% CI=1.99∼3.03), Model 2에서 MHOW군 1.90배(95% CI=1.52∼2.37), MHO군 2.31배(95% CI=1.87∼2.86), Model 3에서 MHOW군 1.89배(95% CI=1.52∼2.37), MHO군 2.34배(95% CI=1.88∼2.90)로 시간에 따라 대사증후군 발생 위험이 증가하였으며 모두 통계적으로 유의하였다.
연구결과
1) 모델 적합도 평가
2) 신체 표현형에 따른 대사증후군의 발생 비례위험: 회귀분석 결과
- 본 연구는 한국인유전체역학조사사업에서 수집한 지역사회기반 코호트의 종단자료를 이용하여 40∼64세의 대사적으로 건강한 성인에서 신체 표현형에 따른 대사증후군 발생 위험에 미치는 영향을 평가하고, 시간이 지남에 따라 대사 건강을 유지하는지를 확인하고, 대사증후군 구성요인에서 발생할 수 있는 변화를 조사하여 체중조절과 대사증후군 예방 및 건강증진 교육의 기초자료로 제공하기 위해 시행되었다. 대사증후군 발생에 영향을 미치는 요인으로는 남자는 연령, 직업 유무, 소득수준, 고혈압 가족력이었으며, 여자는 연령, 직업 유무, 교육수준, 소득수준, 주관적 건강상태, 평균 수면시간, 폐경 유무로 나타났다.
- 본 연구에서 대사증후군이 없는 남자와 여자를 14년 추적 관찰한 결과, 대사증후군의 발생률은 남자 41.5%, 여자 43.3%로 높게 나타났으며 모두 연령이 증가할수록 더 높았다. Lym 등[22]의 연구에서도 남자는 30대에서 대사증후군 유병률이 급격하게 증가하였고, 70대 이상에서 가장 높았으며, 여자는 50대에서 유병률이 급격하게 증가하였고, 60대에서 가장 높은 유병률을 보였다. 이러한 결과는 연령이 높아짐에 따라 대사증후군 구성요인에 해당하는 질환들을 보유할 가능성이 큼을 암시하며 특히 여자는 폐경기 전에는 일정한 신체조성을 유지하는 반면 폐경기 후에는 호르몬의 변화, 대사 활동성 조직의 감소, 약 2.5%의 지방이 증가됨과 관련이 있는 것으로 보고되고 있다[23].
- 남자와 여자 모두에서 직업이 있는 경우 직업이 없는 경우보다 대사증후군의 유병률이 더 높게 나타났으며 이러한 결과는 선행연구와 유사하였다[24]. 이와 반대로 직업이 있는 경우 규칙적인 생활을 하므로 대사증후군에 이환될 가능성이 낮았다는 보고도 있다[25]. 노르웨이에서 유급 노동(paid work) 성인을 대상으로 평균 12.4년 추적 기간 동안 직장에서 좌식 작업을 하는 사람은 2.74배, 육체 노동이 많은 사람은 3.02배로 모든 원인으로 인한 사망과 연관성이 있었으며 주로 심혈관계질환으로 사망한 것으로 보고되었다[26]. 이상의 상이한 결과를 확인하기 위하여 추후 연구에서는 직업에 따른 대사증후군의 비교 시 단순한 직업 유무보다는 신체활동 정도를 반영한 직업으로 대사증후군의 차이를 비교할 필요가 있으며, 전업주부를 포함한 직업군에 따른 대사증후군 유병률 비교를 위한 연구가 필요하리라 생각된다.
- 여자에서 교육수준이 고졸 이하인 경우 대사증후군의 유병률이 높았으며, Lee [27]와 Kim과 Baek [28]의 연구에서도 교육수준이 낮을수록 대사증후군에 영향을 주었으며, 남자보다 여자에서 강한 상관관계가 있는 것으로 나타났다. 학력은 건강결정요인에서도 중요한 요인[29]이므로 일반적으로 여자는 남자보다 건강에 대한 관심도가 높으므로[30] 학력수준이 낮은 여성을 위한 건강지식의 획득과 건강생활실천 향상을 위한 정보와 자원을 쉽게 접근할 수 있는 환경을 제공하는 등 적극적인 대사증후군을 예방하는 방안이 필요하겠다. 남자는 월 평균 수입이 많을수록, 여자는 적을수록 대사증후군의 유병률이 높았으며, Lee [27]의 연구에서 고소득자에서 유의하게 대사증후군 위험이 증가하는 경향을 보였고 이와 반대로 소득수준이 대사증후군이 있는 집단은 정상군보다 하위의 비율이 높고 상위의 비율이 낮았으며, 최저소득 집단에서 대사증후군 발생의 오즈비가 증가하였다[31]. 소득수준에 따라서 대사증후군 위험에 노출되는 정도가 다르다는 것을 알 수 있으며 특히 저소득층의 여자의 경우 경제적인 이유로 질병 예방을 위한 건강행태에 대한 관심이 적을 수 있으므로 적극적인 교육이 필요할 것으로 생각된다. 또한 소득수준이 높을 경우 권장 영양섭취 기준을 초과하는 섭취비율이 높고 지방 및 전체 에너지를 더 많이 섭취하는 서구화된 식습관으로 변하는 경향이 있어[32] 이로 인하여 고지혈증, 비만 등이 유발되기 쉬워 대사증후군 발생으로 이어지기 쉽다고 본다.
- 본 연구결과 여자에서 평소에 본인의 건강상태에 대해 보통과 건강하지 않다라고 느끼는 경우와 평소 수면시간이 많을수록 대사증후군의 유병률이 높은 것으로 나타났다. Lee [27]의 연구에서도 건강하지 않다라고 느끼는 경우 대사증후군 위험이 높았으며, Jung [33]의 연구에서도 9시간 이상인 과다 수면일수록 적정 수면보다 대사증후군과의 관련성이 높았는데 이는 대사증후군 위험요인 중 혈압은 수면시간에 따라 유의한 차이가 있어 과다 수면인 경우 혈압에 영향을 미쳐 대사증후군 유병률 증가로 이어질 수 있음을 보여준다. 본 연구에서도 체질량지수가 증가할수록 자신의 건강을 나쁘게 인식하였고, 정상 수면보다 과다 수면에서 주관적 건강상태가 낮다는 선행연구 결과들과 일치되는 결과를 보였다. 주관적 건강상태는 건강관련 삶의 질의 하나의 지표가 될 수 있으므로 건강관리 측면에서 반드시 다루어져야 할 요소라고 생각된다.
- 남자에서 고혈압 가족력이 없는 경우 대사증후군의 유병률이 높은 것으로 나타났다. 선행연구에서 고혈압 가족력 유무는 대사증후군의 유병률 차이가 없다는 연구[34], 고혈압 가족력이 있는 남자에서 대사증후군 발생 오즈비가 1.41배 높다는 연구[35], 양쪽 부모 모두 고혈압 가족력이 있는 경우 비교위험도가 8.3배까지 증가하여 대사증후군의 발생에 유전과 가족력이 중요한 역할을 한다는 연구[36] 등 연구마다 결과에 차이가 있었다. 이러한 이유는 교란변수와 생활습관 관련 요인에 대한 보정이 차이가 났기 때문으로 여겨진다. 가족력은 유전적 요인과 함께 한 가족이 공유하는 환경과 생활습관을 반영하기 때문에 발생 위험에 영향을 미칠 수 있지만 전적으로 유전적 요인의 영향을 반영한다고 볼 수 없으나 특히 고혈압 가족력이 있는 남자는 대사증후군 예방에 더 주력해야 한다는 점을 시사하고 있다고 볼 수 있겠다.
- 대상자의 신체 표현형에 따른 대사증후군의 발생 위험은 남자는 MHNW군에 비해 MHOW군과 MHO군이 대사증후군 발생이 남자는 공변량 보정 후 MHOW군 1.96배, MHO군 3.11배 대사증후군의 발생 위험이 높은 것으로 나타났으며, 여자는 공변량 보정 후 MHOW군 1.89배, MHO군 2.70배 대사증후군의 발생 위험이 높은 것으로 나타났다. 남자와 여자 모두에서 모든 대사증후군 구성요인의 대사 이상이 MHOW군과 MHO군에서 위험이 증가하였다. 즉, 남자와 여자 모두에서 MHNW군에 비해 MHOW군과 MHO군은 대사증후군과 구성요인의 발생 위험을 높이는 것이는 것으로 나타났다. 따라서 MHOW와 MHO 개인을 식별하면 조기 위험 계층화와 보다 효과적인 중재 개입이 가능할 수 있을 것으로 생각된다.
- Chang 등[15]의 연구에서도 대사증후군 발생의 위험비는 공변량 보정 후 MHNW군에 비해 MHOW군 1.69배, MHO군 1.84배 높았으며 시간의존 모델에서 MHOW군 2.76배, MHO군 3.40배 더 많이 발생하는 것으로 나타났으며 모든 대사증후군 구성요인의 대사 이상이 MHOW군과 MHO군에서 위험이 증가하여 현재는 대사적으로 건강하지만 BMI가 높을수록 시간이 경과함에 따라 비만과 관련된 대사 장애 질환을 겪는다는 것을 알 수 있고 MHOW군과 MHO군은 MHNW군만큼 건강하지 않다는 것을 시사하고 있다. 또한 기반조사로부터 1.8년 추적 기간 동안 안정된 체중변화(-1.0∼1.0kg)를 보인 대상자만을 분석하였을 때 대사 이상 중 하나가 발생할 위험이 증가하였다. 본 연구에서도 기반조사에서 대사 이상이 없었던 대상자가 2년 후 추적하였을 때 대사증후군과 구성요인의 발생자가 남녀 모두에서 MHO군에서 급격히 증가하였고 MHOW군에서도 심각한 수준이었으며 시간의존 모델에서도 발생 위험은 여전히 높았다. 따라서 과체중 및 비만 환자를 주의 깊게 모니터링하고, 건강한 체중과 생활 방식에 대해 상담하는 것 외에도 대사 프로파일을 주의 깊게 관찰해야 하겠다.
- MHNW군에 비해 심뇌혈관 사망률의 위험이 10년 이상 추적 기간 동안 MHOW군의 상대적 위험비 1.21배, MHO군의 상대적 위험비 1.24배[37], 7년 추적 기간 동안 MHO군은 MHNW군에 비해 심뇌혈관 사망률의 위험이 남자 1.45배, 여자 1.04배 위험이 증가하였다[38].
- 노르웨이에서 세계당뇨연맹(International Diabetes Federation, IDF) 진단기준에 따른 성인의 대사증후군 유병률 관련 요인으로 정상체중군에 비해 비만군에서 오즈비가 14.08배로 가장 높게 나타났다[39]. 미국에서 수행된 단면연구에서 성인의 대사증후군 유병률은 BMI가 25∼30㎏/m2인 경우 44.3%, 30㎏/m2 이상인 경우 65.1%로 BMI가 큰 경우 대사증후군의 유병률도 더욱 높게 나타난 것으로 보고되었고[40], 본 연구에서도 남자는 MHOW군 54.3%, MHO군 81.9%, 여자는 MHOW군 57.7%, MHO군 85.8%로 높게 나타나 BMI가 클수록 대사증후군 유병률도 높아 선행연구와 유사한 결과이다.
- Ervin [41]의 연구에서도 BMI가 대사증후군에 중요한 위험요인으로 보고되었는데, 정상체중과 저체중에 비해 과체중에서 대사증후군 위험 6.17배, 비만에서 31.92배로 보고되었고 비만은 혈압과 혈당 상승, 고지혈증, 고밀도지단백 콜레스테롤 수치를 낮추며 인슐린 저항성의 유발에 관여하여 심혈관질환 위험을 높이는 요인[42]이기 때문에 적극적인 관리가 필요하다. 연구마다 유병률이나 오즈비 및 위험비에 있어서 차이는 있지만, 비만은 대사증후군 유병률과 관련 요인 가운데 하나라고 할 수 있다.
논의
- 본 연구 결과 대사적으로 건강할지라도 과제중이나 비만의 경우에는 대사증후군 발생률이 높다는 것을 발견하였다. 따라서, 과체중과 비만 환자를 주의 깊게 모니터링하여 건강한 체중과 생활양식에 대해 상담하고 대사증후군 구성요인을 신중하게 감시하고 과체중과 비만 환자는 대사증후군 예방관리를 위해서는 스스로의 대사증후군 구성요인 수치를 바로 알고 관리하는 것이 중요하겠다. 본 연구의 강점은 14년의 긴 추적 기간과 시간변화에 따른 신체 표현형의 변화를 반영한 통계기법의 사용, 그리고 인구사회학적 요인 및 건강생활습관 요인 등을 통제하였다는 점이다. 유전과 같은 대사증후군 발생에 영향을 미치는 다양한 요인을 통제하기 위해 향후 추가적인 대규모 코호트 구축과 환경요인을 파악하기 위한 광범위한 자료구축 등이 지속적으로 수행되어야 하겠다. 또한, 대사증후군 구성요인 중 1~2개의 위험인자를 보유한 인구집단을 대상으로 시간변화에 따른 건강결과도 확인하는 연구를 제안한다.
결론
-
Conflict of interest
The authors declared no conflict of interest.
-
Funding
None.
-
Authors’ contributions
Kim, Ji Young contributed to data curation, formal analysis, methodology, visualization, writing - original draft, review & editing, and investigation. Yang, Youngran contributed to conceptualization, methodology, project administration, visualization, writing - review & editing, investigation, software, supervision, and validation.
-
Data availability
Available upon reasonable reasons.
NOTES
Acknowledgments
| Characteristics | Categories |
Male (n=2,684) |
χ2 (p) |
Female (n=2,384) |
χ2 (p) | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
|
Metabolic syndrome |
Metabolic syndrome |
||||||||||
|
Yes (n=1,113) |
No (n=1,571) |
Yes (n=1,032) |
No (n=1,352) |
||||||||
| n (%) | n (%) | n (%) | n (%) | ||||||||
| Age (years) | 40∼49 | 667 | (40.3) | 990 | (59.7) | 7.40 (.025) | 546 | (36.0) | 969 | (64.0) | 92.66 (<.001) |
| 50∼59 | 296 | (41.2) | 422 | (58.8) | 322 | (53.8) | 277 | (46.2) | |||
| 60∼64 | 150 | (48.5) | 159 | (51.5) | 164 | (60.7) | 106 | (39.3) | |||
| Spouse | Yes | 1,063 | (41.3) | 1,509 | (58.7) | 0.53 (.468) | 919 | (42.7) | 1,231 | (57.3) | 2.36 (.124) |
| No | 48 | (44.9) | 59 | (55.1) | 110 | (48.0) | 119 | (52.0) | |||
| Occupation | Employed | 898 | (43.1) | 1,185 | (56.9) | 10.20† (.003) | 409 | (48.2) | 440 | (51.8) | 13.24 (.001) |
| Unemployed | 1 | (33.3) | 2 | (66.7) | 545 | (40.9) | 789 | (59.1) | |||
| Others | 212 | (35.9) | 379 | (64.1) | 74 | (38.5) | 118 | (61.5) | |||
| Education | ≤ High school | 867 | (42.5) | 1,173 | (57.5) | 3.52 (.061) | 966 | (44.4) | 1,208 | (55.6) | 13.21 (<.001) |
| ≥ College | 244 | (38.3) | 393 | (61.7) | 63 | (31.2) | 139 | (68.8) | |||
| Monthly income (10,000 won) | < 200 | 598 | (42.5) | 808 | (57.5) | 6.93 (.031) | 694 | (49.1) | 719 | (50.9) | 54.56 (<.001) |
| 200∼< 400 | 378 | (38.5) | 603 | (61.5) | 257 | (34.3) | 493 | (65.7) | |||
| ≥ 400 | 129 | (46.4) | 149 | (53.6) | 56 | (31.5) | 122 | (68.5) | |||
| Self-reported health status | Healthy | 441 | (41.6) | 618 | (58.4) | 3.76 (.153) | 279 | (39.5) | 427 | (60.5) | 6.15 (.046) |
| Average | 450 | (43.0) | 597 | (57.0) | 413 | (45.4) | 497 | (54.6) | |||
| Unhealthy | 218 | (38.0) | 355 | (62.0) | 338 | (44.5) | 422 | (55.5) | |||
| Fatigue | Yes | 619 | (41.8) | 862 | (58.2) | 0.33 (.567) | 628 | (42.9) | 837 | (57.1) | 0.08 (.782) |
| No | 479 | (40.7) | 698 | (59.3) | 388 | (43.4) | 505 | (56.6) | |||
| Cigarette smoking | Never smoker | 204 | (38.3) | 328 | (61.7) | 5.01 (.082) | 983 | (43.6) | 1,270 | (56.4) | 2.74 (.254) |
| Former smoker | 318 | (40.3) | 472 | (59.7) | 12 | (46.2) | 14 | (53.8) | |||
| Current smoker | 590 | (43.5) | 765 | (56.5) | 26 | (34.2) | 50 | (65.8) | |||
| Alcohol consumption | Never drinker | 207 | (41.8) | 288 | (58.2) | 0.38 (.826) | 670 | (43.0) | 887 | (57.0) | 1.31 (.519) |
| Former drinker | 95 | (39.6) | 145 | (60.4) | 27 | (50.9) | 26 | (49.1) | |||
| Current drinker | 808 | (41.6) | 1,136 | (58.4) | 329 | (43.2) | 433 | (56.8) | |||
| Physical activity | Yes | 137 | (42.3) | 187 | (57.7) | 0.02 (.891) | 153 | (42.5) | 207 | (57.5) | 0.44 (.506) |
| No | 207 | (42.8) | 277 | (57.2) | 149 | (45.0) | 182 | (55.0) | |||
| Sleep duration (per night) | ≤ 6h | 426 | (40.0) | 639 | (60.0) | 1.44 (.487) | 460 | (39.6) | 703 | (60.4) | 14.05 (.001) |
| 7∼8h | 602 | (42.4) | 818 | (57.6) | 498 | (46.1) | 582 | (53.9) | |||
| ≥ 9h | 77 | (41.4) | 109 | (58.6) | 67 | (51.9) | 62 | (48.1) | |||
| Family history of HTN | Yes | 237 | (50.2) | 235 | (49.8) | 18.04 (<.001) | 218 | (45.5) | 261 | (54.5) | 1.21 (.272) |
| No | 1,336 | (60.4) | 876 | (39.6) | 814 | (42.7) | 1,091 | (57.3) | |||
| Family history of DM | Yes | 139 | (45.3) | 168 | (54.7) | 2.07 (.150) | 141 | (43.8) | 181 | (56.2) | 0.04 (.846) |
| No | 974 | (41.0) | 1,403 | (59.0) | 891 | (43.2) | 1,171 | (56.8) | |||
| Menopause | Yes | - | - | 428 | (63.5) | 246 | (36.5) | 68.76 (<.001) | |||
| No | - | - | 451 | (43.0) | 597 | (57.0) | |||||
| Gender | Body size phenotype | Person-year | n†(%) | Incidence‡ | F (p) | Sheffé test |
|---|---|---|---|---|---|---|
| Male (n=2,684) | MHNWa | 9,138.70 | 268 (26.9) | 29.3 | 92.83 (<.001) | c>b>a |
| MHOWb | 6,740.40 | 366 (43.2) | 54.3 | |||
| MHOc | 5,845.40 | 479 (57.2) | 81.9 | |||
| Female (n=2,384) | MHNWa | 8,031.90 | 253 (28.1) | 31.5 | 81.48 (<.001) | c>b>a |
| MHOWb | 5,481.80 | 316 (46.5) | 57.7 | |||
| MHOc | 5,398.80 | 463 (57.4) | 85.8 |
- 1. Noubiap JJ, Nansseu JR, Lontchi-Yimagou E, Nkeck JR, Nyaga UF, Ngouo AT, et al. Geographic distribution of metabolic syndrome and its components in the general adult population: A meta-analysis of global data from 28 million individuals. Diabetes Research and Clinical Practice. 2022;188:109924. https://doi.org/10.1016/j.diabres.2022.109924ArticlePubMed
- 2. National Health Insurance Service. 2018 Health checkup statistical annual report [Internet]. Gangwon-Do: National Health Insurance Service. 2019 Dec 27 [cited 2022 Jul 25]. Available from: https://www.nhis.or.kr/nhis/together/wbhaea01600m01.do?mode=view&articleNo=10803724
- 3. Mottillo S, Filion KB, Genest J, Joseph L, Pilote L, Poirier P, et al. The metabolic syndrome and cardiovascular risk: A systematic review and meta-analysis. Journal of the American College of Cardiology. 2010;56(14):1113–1132. https://doi.org/10.1016/j.jacc.2010.05.034ArticlePubMed
- 4. Takahara M, Shimomura I. Metabolic syndrome and lifestyle modification. Reviews in Endocrine and Metabolic Disorders. 2014;15(4):317–327. https://doi.org/10.1007/s11154-014-9294-8ArticlePubMed
- 5. Ortega FB, Lavie CJ, Blair SN. Obesity and cardiovascular disease. Circulation Research. 2016;118(11):1752–1770. https://doi.org/10.1161/CIRCRESAHA.115.306883ArticlePubMed
- 6. Karelis AD. Metabolically healthy but obese individuals. Lancet. 2008;372(9646):1281–1283. https://doi.org/10.1016/s0140-6736(08)61531-7Article
- 7. Wildman RP, Muntner P, Reynolds K, McGinn AP, Rajpathak S, Wylie-Rosett J, et al. The obese without cardiometabolic risk factor clustering and the normal weight with cardiometabolic risk factor clustering: Prevalence and correlates of 2 phenotypes among the US population (NHANES 1999-2004). Archives of Internal Medicine. 2008;168(15):1617–1624. https://doi.org/10.1001/archinte.168.15.1617ArticlePubMed
- 8. Phillips CM. Metabolically healthy obesity: Definitions, determinants and clinical implications. Reviews in Endocrine and Metabolic Disorders. 2013;14(3):219–227. https://doi.org/10.1007/s11154-013-9252-xArticle
- 9. Samocha‐Bonet D, Dixit VD, Kahn CR, Leibel RL, Lin X, Nieuwdorp M, et al. Metabolically healthy and unhealthy obese-The 2013 stock conference report. Obesity Reviews: An Official Journal of the International Association for the Study of Obesity. 2014;15(9):697–708. https://doi.org/10.1111/obr.12199ArticlePMC
- 10. Hinnouho GM, Czernichow S, Dugravot A, Batty GD, Kivimaki M, Singh-Manoux A. Metabolically healthy obesity and risk of mortality: Does the definition of metabolic health matter? Diabetes Care. 2013;36(8):2294–2300. https://doi.org/10.2337/dc12-1654ArticlePubMed
- 11. Ärnlöv J, Ingelsson E, Sundström J, Lind L. Impact of body mass index and the metabolic syndrome on the risk of cardiovascular disease and death in middle-aged men. Circulation. 2010;121(2):230–236. https://doi.org/10.1161/circulationaha.109.887521ArticlePubMed
- 12. Kushner RF. Obesity management. Gastroenterology Clinics of North America. 2007;36(1):191–210. https://doi.org/10.1016/j.gtc.2007.01.004ArticlePubMed
- 13. Espinosa De Ycaza AE, Donegan D, Jensen MD. Long-term metabolic risk for the metabolically healthy overweight/obese phenotype. International Journal of Obesity. 2017;42(3):302–309. https://doi.org/10.1038/ijo.2017.233ArticlePubMedPMC
- 14. Liu X, Zhang J, Wu J, Xu X, Tao L, Sun Y, et al. The impact of BMI categories on metabolic abnormality development in Chinese adults who are metabolically healthy: A 7-year prospective study. Diabetes, Metabolic Syndrome and Obesity: Targets and Therapy,. 2020;13:819–834. https://doi.org/10.2147/dmso.s237550ArticlePubMed
- 15. Chang Y, Ryu S, Suh BS, Yun KE, Kim CW, Cho SI. Impact of BMI on the incidence of metabolic abnormalities in metabolically healthy men. International Journal of Obesity (2005). 2012;36(9):1187–1194. https://doi.org/10.1038/ijo.2011.247ArticlePubMed
- 16. Kim JA, Kim DH, Kim SM, Park YG, Kim NH, Baik SH, et al. Impact of the dynamic change of metabolic health status on the incident type 2 diabetes: A nationwide population-based cohort study. Endocrinology and Metabolism. 2019;34(4):406–414. https://doi.org/10.3803/enm.2019.34.4.406ArticlePubMedPMC
- 17. Goldacre M. The role of cohort studies in medical research. Pharmacoepidemiology and Drug Safety. 2001;10(1):5–11. https://doi.org/10.1002/pds.562ArticlePubMed
- 18. Korean Society for the Study of Obesity. Obesity treatment guidelines [Internet]. Seoul: Korean Society for the Study of Obesity. 2020 May 19 [cited 2022 Jul 25]. Available from: http://general.kosso.or.kr/html/?pmode=BBBS0001300003&page=1&smode=view&seq=1358&searchValue=&searchTitle=strTitle
- 19. Levy JC, Matthews DR, Hermans MP. Correct homeostasis model assessment (HOMA) evaluation uses the computer program. Diabetes Care. 1998;21(12):2191–2192. https://doi.org/10.2337/diacare.21.12.2191ArticlePubMed
- 20. The Korean Nutrition Society. 2010 Dietary reference intakes for Koreans [Internet]. 2010 Oct 29 [cited 2022 Aug 10]. Available from: http://www.kns.or.kr/FileRoom/FileRoom.asp?restring=&idx=108&page=&xsearch=&cn_search=&BoardID=Kdr
- 21. Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults. Executive summary of the third report of the national cholesterol education program (NCEP) expert panel on detection, evaluation, and treatment of high blood cholesterol in adults (Adult Treatment Panel III). JAMA. 2001;285(19):2486–2497. https://doi.org/10.1001/jama.285.19.2486ArticlePubMed
- 22. Lym YL, Hwang SW, Shim HJ, Oh EH, Chang YS, Cho BL. Prevalence and risk factors of the metabolic syndrome as defined by NCEP-ATP III. Korean Journal of Family Medicine. 2003;24(2):135–143.
- 23. Lovejoy JC, Champagne CM, De Jonge L, Xie H, Smith SR. Increased visceral fat and decreased energy expenditure during the menopausal transition. International Journal of Obesity. 2008;32(6):949–958. https://doi.org/10.1038/ijo.2008.25ArticlePubMedPMC
- 24. Im MY. The effect of stress on prevalence risk of metabolic syndrome among Korean adults. Korean Journal of Stress Research. 2019;27(4):441–447. https://doi.org/10.17547/kjsr.2019.27.4.441Article
- 25. Deedwania PC, Gupta R, Sharma KK, Achari V, Gupta B, Maheshwari A, et al. High prevalence of metabolic syndrome among urban subjects in India: A multisite study. Diabetes & Metabolic Syndrome: Clinical Research & Reviews. 2014;8(3):156–161. https://doi.org/10.1016/j.dsx.2014.04.033Article
- 26. Moe B, Mork PJ, Holtermann A, Nilsen TIL. Occupational physical activity, metabolic syndrome and risk of death from all causes and cardiovascular disease in the HUNT 2 cohort study. Occupational and Environmental Medicine. 2013;70(2):86–90. https://doi.org/10.1136/oemed-2012-100734ArticlePubMed
- 27. Lee EH. Prevalence of metabolic syndrome and health behaviors among Koreans. Journal of Korea Association of Health Promotion. 2005;3(2):199–218.
- 28. Kim EY, Baek HJ. Association between metabolic syndrome and macronutrient intakes in adults aged 50 years and older based on the 2013-2017 Korean national health and nutrition examination survey data. Journal of the Korean Society of Food Culture,. 2020;35(3):294–301. https://doi.org/10.7318/KJFC/2020.35.3.294Article
- 29. You SY. A study of health status and health care associatedwith the subjective social class. Journal of Consumption Culture. 2006;9(2):167–185.
- 30. Kang HM, Kim DJ. Gender differences in the association of socioeconomic status with metabolic syndrome in middle-aged Koreans. The Korean Journal of Medicine. 2012;82(5):569–575. http://doi.org/10.3904/kjm.2012.82.5.569Article
- 31. Dallongeville J, Cottel D, Ferrières J, Arveiler D, Bingham A, Ruidavets JB, et al. Household income is associated with the risk of metabolic syndrome in a sex-specific manner. Diabetes Care. 2005;28(2):409–415. https://doi.org/10.2337/diacare.28.2.409ArticlePubMed
- 32. Koo S, Park K. Dietary behaviors and lifestyle characteristics related to frequent eating out among Korean adults. Journal of the Korean Society of Food Science and Nutrition. 2013;42(5):705–712. https://doi.org/10.3746/jkfn.2013.42.5.705Article
- 33. Jung YN. Association between sleep duration and metabolic syndrome in Korean adults: Korea national health and nutrition examination survey 2016-2017 [master’s thesis]. [Kongju]; Kongju National University General Graduate school: 2020.
- 34. Cho YC, Kwon IS, Park JY, Shin MW. Prevalence of metabolic syndrome and its associated factors among health checkup examinees in a university hospital. Journal of the Korea Academia-Industrial Cooperation Society. 2012;13(11):5317–5325. https://doi.org/10.5762/kais.2012.13.11.5317Article
- 35. Paek KW, Chun KH, Lee KW. Relationship between metabolic syndrome and familial history of hypertension/stroke, diabetes, and cardiovascular disease. Journal of Korean Medical Science. 2006;21(4):701–708. https://doi.org/10.3346/jkms.2006.21.4.701ArticlePubMedPMC
- 36. Liese AD, Mayer-Davis EJ, Tyroler HA, Davis CE, Keil U, Schmidt MI, et al. Familial components of the multiple metabolic syndrome: The ARIC study. Diabetologia. 1997;40(8):963–970. https://doi.org/10.1007/s001250050775ArticlePubMed
- 37. Kramer CK, Zinman B, Retnakaran R. Are metabolically healthy overweight and obesity benign conditions?: A systematic review and meta-analysis. Annals of Internal Medicine. 2013;159(11):758–769. https://doi.org/10.7326/0003-4819-159-11-201312030-00008ArticlePubMed
- 38. Hamer M, Stamatakis E. Metabolically healthy obesity and risk of all-cause and cardiovascular disease mortality. The Journal of Clinical Endocrinology & Metabolism. 2012;97(7):2482–2488. https://doi.org/10.1210/jc.2011-3475Article
- 39. Zimmet PZ, Alberti K, Shaw J. International diabetes federation: The IDF consensus worldwide definition of the metabolic syndrome. Diabetes Voice. 2005;50:31–33.
- 40. Ford ES. Prevalence of the metabolic syndrome defined by the international diabetes federation among adults in the U.S. Diabetes Care. 2005;28(11):2745–2749. https://doi.org/10.2337/diacare.28.11.2745ArticlePubMed
- 41. Ervin RB. Prevalence of metabolic syndrome among adults 20 years of age and over, by sex, age, race and ethnicity, and body mass index: United States, 2003-2006. National health statistics report 2009;(13):1–7.
- 42. Alberti KGMM, Zimmet P, Shaw J. Metabolic syndrome--A new world‐wide definition. A consensus statement from the international diabetes federation. Diabetic Medicine : A Journal of the British DIabetic Association. 2006;23(5):469–480. https://doi.org/10.1111/j.1464-5491.2006.01858.xArticlePubMed
References
Figure & Data
References
Citations


 KACHN
KACHN

 PubReader
PubReader ePub Link
ePub Link Cite
Cite